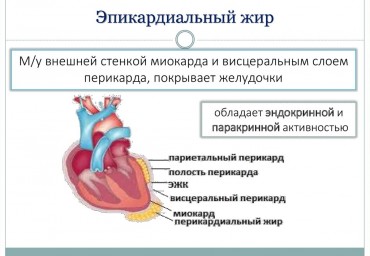
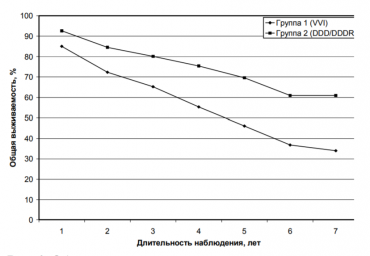
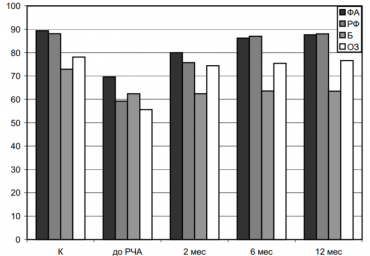
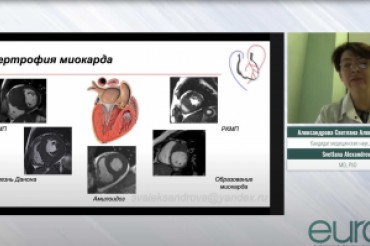
Взаимосвязь гомоцистеина, пролина и глицина со структурно-функциональным ремоделированием миокарда у пациентов с пароксизмальной и персистирующей формами фибрилляции предсердий
Фибрилляция предсердий (ФП) в настоящее время является наиболее распространенной формой аритмии, частота случаев которой закономерно увеличивается с возрастом [1–3]. ФП ассоциирована с целым рядом сердечно-сосудистых состояний, которые являются доказанными факторами риска развития и прогрессирования аритмии: артериальной гипертензией (АГ), хронической сердечной недостаточностью (ХСН), клапанной патологией сердца, кардиомиопатией, ишемической болезнью сердца (ИБС) [6–8].
В связи с увеличением продолжительности жизни, улучшением показателей выживаемости у больных с ИБС, ХСН, АГ очевидным будет увеличение распространенности ФП в будущем. Данный вид аритмии накладывает существенное бремя расходов на систему здравоохранения из-за высокой распространенности [9]. Проблема выделения лиц с повышенным риском возникновения пароксизмальных нарушений ритма сердца тесно связана с патофизиологическими механизмами, лежащими в основе аритмогенеза. Как известно, аритмические осложнения обычно возникают у пациентов, у которых имеет место структурная перестройка миокарда, чаще всего связанная с ИБС, поэтому и изучение механизмов нарушений сердечного ритма, протекающих на фоне ИБС, вызывает особый интерес в связи с их потенциальной опасностью для жизни больного [10].
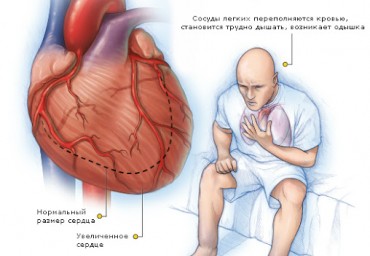
Однако у 20–50% больных ФП не ассоциируется с другими заболеваниями сердца. Одной из важных клинических особенностей этой аритмии является тенденция перехода ее со временем в персистирующую и хроническую. Как следствие этого, восстановление и удержание синусового ритма фармакологическими или электрическими методами становится тем сложнее, чем дольше ФП существует. Термин «ремоделирование» означает электрофизиологические и структурные изменения, способствующие поддержанию и повторному возникновению ФП. Первые связаны с изменением электрических свойств предсердий, а структурное ремоделирование, как показано на основе данных экспериментальных моделей, ассоциируется с изменениями в ткани и клеточной архитектуре.
Вместе указанные механизмы повышают возможность образования в предсердиях множественных петель возбуждения, обусловливают частую активацию предсердий и дисперсию рефрактерности [11]. Наличие ФП в анамнезе приводит к инсультам кардиоэмболической природы в 45% случаев, а 15% приходится на долю инфаркта миокарда с тромбозом полости левого желудочка, что позволяет рассматривать ФП как весьма значимый причинный фактор кардиогенных тромбоэмболий, достаточно распространенных проявлений артериальных тромбозов. Идентификация дополнительных факторов риска тромбоэмболии способствует выработке более действенных дифференцированных подходов к ее профилактике.
Пока, однако, приходится констатировать, что, несмотря на большое количество публикаций по этой теме, в литературе слишком часто встречаются взаимоисключающие оценки степени тромбоопасности многих факторов. В том числе это касается гипергомоцистеинемии (HHcy) в провоцировании сердечно-сосудистых и тромботических осложнений [12].

Задайте их прямо тут и получите ответ!
Или перейдите в раздел для пациентов и найдите