Сопоставление клинических данных и результатов математического моделирования при радиочастотной абляции у пациентов c постоянной формой фибрилляции предсердий: кардиоверсия как заключительный этап комбинированного лечения
Радиочастотная катетерная абляция (РЧА) субстрата постоянной формы фибрилляции предсердий (ФП) — наиболее эффективный метод лечения больных этой аритмией [1, 2]. Накопилось значительное количество данных о клинических результатах РЧА у пациентов этой категории, которые свидетельствуют о возможности поддержания синусового ритма (СР) у 60—80% пациентов в отдаленном периоде после интервенционного лечения [1—4].
В настоящее время в клинической практике используется преимущественно комбинированная методика РЧА, включающая остиальную радиочастотную (РЧ) изоляцию устьев легочных вен (ЛВ), нанесение линейных РЧ-повреждений в левом предсердии (ЛП), а также абляцию в области регистрации фрагментированных электрограмм в ЛП и в коронарном синусе (КС). В 2005 г. группа M. Haissaguerre для данной методики предложила использовать термин пошаговой абляции и продемонстрировала, что ее использование приводит к организации цикла ФП, трансформации ее в предсердную тахикардию и/или трепетание предсердий (ТП) с последующим восстановлением СР у 87% пациентов без проведения электроимпульсной терапии (ЭИТ) [5—8]. В 2006 г. H. Oral и соавт. опубликовали результаты РЧА у пациентов с постоянной формой ФП. Из 77 пациентов, которым проводилось интервенционное лечение, СР восстанавливался на фоне проведения РЧА только у 16%, а методом наружной ЭИТ после РЧА в ЛП — у 84%. Устойчивый СР сохранялся в 74% случаев в течение 204±82 дней наблюдения [3, 9, 10].
Таким образом, полученные данные свидетельствуют о том, что унифицированный методический подход к РЧА субстрата постоянной ФП в настоящее время отсутствует. Существующее научное обоснование тактики РЧА у больных постоянной ФП в сочетании с ЭИТ или без него и антиаритмической терапией (ААТ) не в полной мере объясняет эффект от проведения интервенционного вмешательства и не удовлетворяет требованиям времени. Во многом это может быть связано с тем, что патогенез различных форм ФП нельзя считать полностью изученным. Нам представляется, что автоволновые процессы 6-волнового re-entry в двумерной активной среде, полученные с использованием методики сканирования и с учетом геометрии предсердий, могут являться приемлемой математической моделью постоянной формы ФП [11—13].
Последующее проведение абляционного форматирования (АФ) с помощью создания невозбудимых линий в данной среде, имитирующих лечебные РЧ-воздействия, возможно, позволит определиться с оптимальным методическим подходом к проведению РЧА, и в конечном итоге приблизиться к унификации методики абляции в клинической практике.
Цель исследования — сравнить теоретические возможности элиминации постоянной ФП (на модели 6-волнового re-entry) в условиях математического моделирования АФ и последующей электрической кардиоверсии и сопоставить полученные данные с результатами электрофизиологического исследования (ЭФИ), РЧА и динамического клинического наблюдения за пациентами с постоянной формой ФП.
Материал и методы
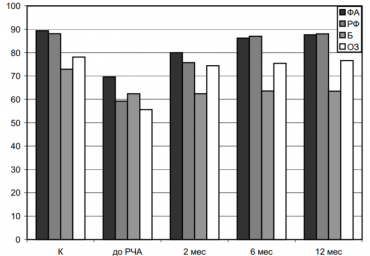
Клинический этап. В настоящее исследование были включены 20 пациентов (6 женщин), средний возраст 51,4±13,6 года с постоянной формой ФП (см. таблицу). Диагноз постоянной формы ФП устанавливали на основании критериев, предложенных в рекомендациях Российского кардиологического общества по диагностике и лечению ФП (2013). Более того, обязательным условием включения в исследование было указание в анамнезе на эпизод неэффективной
наружной электрической кардиоверсии и/или успешной ЭИТ с поддержанием устойчивого СР не более 7 сут, несмотря на проводимую ААТ [14].
Предоперационная подготовка осуществлялась в соответствии c Консенсусом EHRA/АСС от 2012 г. и заключалась в назначении непрямых антикоагулянтов и антиаритмических препаратов как минимум за 4 нед до интервенционного вмешательства. После подписания информированного согласия пациентам
выполняли процедуру эндокардиального ЭФИ и РЧА ФП с использованием электрофизиологической системы и системы нефлюороскопического картирования.
В ходе процедуры пунктировали правую и левую бедренные вены, левую подключичную вену, по Сельдингеру устанавливали интродьюсеры через которые 10- и 4-полюсный диагностические электроды проводили в КС и область верхушки правого желудочка (RVA).
После верификации отсутствия тромбов в ушке ЛП методом внутрисердечной эхокардиографии выполняли пункцию межпредсердной перегородки (под рентгеноскопическим и внутрисердечным ультразвуковым контролем), через трансептальный интродьюсер картирующий электрод вводили в полость ЛП и осуществляли его трехмерную реконструкцию. Следующим этапом проводили РЧ-воздействия вокруг устьев ЛВ (циркулярная изоляция), которые дополняли линейными РЧ-воздействиями в области свода (между устьями верхних левой и правой ЛВ), митрального перешейка (между устьем левой нижней ЛВ и кольцом митрального клапана), а также в области задней стенки ЛП (рис. 1, см. цв. вклейку).
До начала проведения РЧА на электродных парах катетера, установленного в КС, измеряли не менее 10 интервалов цикла ФП, вычисляли их среднее значение. После проведения РЧА в митральном перешейке и по периметру левой нижней ЛВ на электродных парах катетера, установленного в КС, измеряли не менее 10 интервалов цикла ФП, вычисляли среднее значение (рис. 2, см. цв. вклейку). Следующее измерение 10 циклов ФП на электродных парах электрода, установленного в КС, проводили после РЧ-воздействий по периметру левой верхней ЛВ и правых ЛВ (см. рис. 2). Заключительное измерение 10 циклов ФП на электродных парах электрода, установленного в КС, проводили после нанесения линейных РЧ-аппликаций по своду и линейно по задней стенке ЛП (см. рис. 2).
Во всех случаях после завершения РЧА с целью восстановления СР с использованием дефибриллятора выполняли наружную ЭИТ согласно методике, представленной в отечественных рекомендациях по оказанию анестезиологического пособия [15]. В раннем послеоперационном периоде пациенты в течение
24 ч получали гепарин под контролем активированного частичного тромбопластинового времени с последующим возобновлением терапии непрямыми антикоагулянтами и антиаритмическими препаратами. После проведения РЧА в течение 3—6 мес все пациенты продолжали принимать антиаритмические препараты и антикоагулянты под контролем международного нормализованного отношения с последующим принятием решения лечащим врачом о целесообразности их отмены.
Клиническое наблюдение заключалось в оценке жалоб пациента, проведении физического обследования, регистрации 12 отведений электрокардиограммы и ее холтеровского мониторирования через 3, 6 и 12 мес после выполнения РЧА.
Применение интервенционных методов для лечения этих больных – все еще нерешенная проблема современной кардиологии. Мы приводим клинический пример успешного комбинированного интервенционного лечения больного, у которого резистентная АГ была купирована с помощью денервации почечных артерий, а лечение недостаточности кровообращения при ФП реализовано, в том числе, с помощью абляции очагов ФП.