Влияние альдостерона и его антагонистов на ремоделирование миокарда у пациентов с фибрилляцией предсердий
Следует признать, что ФП до сих пор остается серьезной и нерешенной проблемой. Актуальность обусловлена тем, что у большинства пациентов ФП неуклонно прогрессирует с развитием персистирующей или постоянной формы на фоне эволюции основного заболевания. В последнее время достигнуты определенные успехи в изучении естественного течения ФП - от бессимптомных форм до необратимой тяжелой аритмии. Предпринимались попытки замедлить или остановить прогрессирование ФП, которое может быть следствием основного ССЗ или естественного течения самой аритмии, однако успехи в этой области ограничены.
Распространенность ФП в общей популяции составляет 1-2%; и этот показатель, вероятно, увеличится в ближайшие 50 лет [2]. Частота случаев ФП увеличивается с возрастом - от <0,5% в возрасте 40-50 лет до 5-15% в возрасте 80 лет [3]. Так, многоцентровые исследования выявили, что распространенность этой патологии составляет около 0,5% в возрасте до 60 лет, после 60 лет - 5%, после 75 лет - более 10%, причем ФП чаще регистрируется у мужчин [2, 3]. Пароксизмы ФП составляют более 1/3 госпитализаций по поводу нарушений ритма сердечной деятельности. В настоящее время ФП наиболее часто ассоциируется с ишемической болезнью сердца (ИБС), хронической сердечной недостаточностью (ХСН), артериальной гипертензией (АГ). В качестве патогенетических механизмов рассматриваются острые или хронические гемодинамические, метаболические и электрофизиологические процессы.
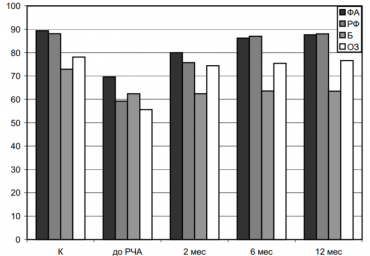
Все указанные факторы способны привести к структурному ремоделированию предсердий, посредством которого развивается и прогрессирует ФП. Ее патогенез связан с комплексом изменений ткани миокарда предсердий - электрическим, структурным, сократительным ремоделированием [25], в том числе со вторичными изменениями левого предсердия (ЛП), обусловленными ремоделированием левого желудочка (ЛЖ) под действием перегрузки давлением. Морфологическим субстратом ремоделирования являются процессы, происходящие на всех уровнях структурной организации сердца. Это активация определенных участков генома, молекулярные, клеточные, интерстициальные изменения, клинически выражающиеся в изменениях размера, формы и функциональных возможностей сердца в ответ на действие патологического фактора.
На процесс сердечного ремоделирования влияют гемодинамические условия, нейрогормональная активация и ряд других факторов, которые в настоящее время активно изучаются. Структурное ремоделирование при ФП характеризуется дилатацией и фиброзом предсердий, накоплением повышенного количества соединительной ткани, разъединяющей отдельные миоциты. Фиброз является субстратом механизма microreentry, кругового движения волны возбуждения в миокарде предсердий [16]. После начала ФП в разное время отмечаются изменения электрофизиологических свойств, механической функции и ультраструктуры предсердий, которые имеют разные патофизиологические последствия [25]. Известно, что развитие ФП приводит к электрофизиологическим и клеточным изменениям в предсердии, что, в свою очередь, способствует сохранению ФП, а в дальнейшем вызывает электрофизиологическое ремоделирование [7]. Установлено, что электрофизиологическое ремоделирование влияет на частые случаи раннего срыва ритма и на возобновление ФП [24].
Основными характеристиками этого процесса является укорочение рефрактерного периода с увеличенной дисперсией, сни- жение уровня адаптации, нарушение проводимости по предсердию [30]. Основными клеточными механизмами, лежащими в основе укорочения рефрактерного периода, являются подавление тока ионов кальция через каналы L-типа и усиление поступления ионов калия в клетки [24]. Укорочение рефрактерного периода предсердий - существенная причина персистирования пароксизмальной ФП.
Чрезмерная нагрузка на миоциты предсердий во время эпизодов фибрилляции через экспрессию генов в предсердных ионных каналах и активацию нейрогуморальных механизмов может запускать механизм структурного ремоделирования [11]. Любые органические заболевания сердца могут вызвать медленное, но прогрессирующее структурное ремоделирование желудочков и предсердий. Оно, в свою очередь, приводит к электрической диссоциации мышечных пучков и неоднородности проведения, что способствует развитию и сохранению ФП. Этот электро-анатомический субстрат вызывает появление множественных небольших очагов циркуляции возбуждения, которые стабилизируют аритмию [16].
Кроме того, структурное и электрофизиологическое ремоделирование взаимосвязаны: гипертрофия и дилатация левых отделов сердца могут ускорять электрофизиологическое ремоделирование, и наоборот [25], одна- ко причины этих результатов остаются неясными. В этой связи вопрос влияния электрофизиологического и структурного ремоделирования сердца на развитие ФП является актуальным и требует изучения.
РААС и ФП К настоящему моменту накоплено большое количество данных о том, что в формировании такой своеобразной "кардиомиопатии предсердий" большое значение имеет активность ренин-ангиотензин-альдостероновой системы (РААС). Вазоконстрикция и задержка жидкости, направленные на поддержание артериального дав ления, эффекты активации РААС, которые, повышая постнагрузку, увеличивают внутрижелудочковое давление, тем самым неблагоприятно влияя на процессы ремоделирования.
В статье, систематизированной по разделам в соответствии с указанным документом, изложены вопросы новой терминологии, новые критерии диагностики синдрома Бругада (сБр) и синдрома ранней
реполяризации желудочков (СРРЖ) с включением новых диагностических шкал.
Крупнейшее многоцентровое международное рандомизированное исследование ISCHEMIA призвано ответить на вопрос об оптимальной стратегии лечения при стабильной ИБС на современном этапе. Цель исследования. В настоящей статье приводится краткий обзор исследования ISCHEMIA и проанализированы важнейшие исходные характеристики вклю‑ чаемых в него пациентов на примере одного российского центра. Материалы и методы. Критериями включения в исследо‑ вание служат наличие положительного стресс‑теста (в нашем центре это стресс‑эхокардиография с физической нагрузкой) с умеренным или высоким риском и подтверждение обструктивной ИБС по данным компьютерной томографической коро‑ нарографии (КТКГ).
В монографии приведены сведения, касающиеся оценки хронотропной функции сердца, описаны новые методы оценки функции автоматизма синусового узла. Приведены данные по этиологии, патогенезу, классификации, клинике и диагностике дисфункций синусового узла.