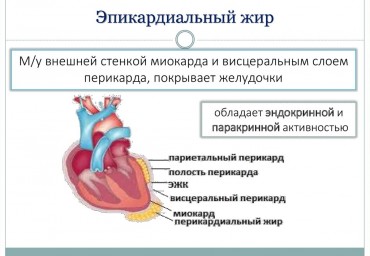
Взаимосвязь значений гомоцистеина, пролина и глицина с клиническим течением пароксизмальной и персистирующей форм фибрилляции предсердий
Этиологические и патофизиологические аспекты возникновения фибрилляции предсердий (ФП) сложны и до конца не изучены. В настоящее время ФП рассматривается как результат сложного взаимодействия различных факторов, таких как электрофизиологические, молекулярно-биологические, генетические изменения, спектр которых варьируется у каждого конкретного пациента и создаёт многообразие патофизиологических вариантов [7]. Две основные теории патогенеза ФП – эктопическая фокусная активность и механизм «re-entry», для возникновения которого необходимо наличие триггеров и поддерживающего субстрата – давно известны [23], но даже при их отсутствии ФП иногда сохраняется [30].
Это происходит в результате структурного и электрического ремоделирования предсердий, которое характеризуется их дилатацией и сокращением эффективного рефрактерного периода. Кроме того, ФП способствует повышению экспрессии белков экстрацеллюлярного матрикса и активацию фиброза в предсердиях [17]. В результате замедляется проведение в предсердиях, что приводит к электрической изоляции кардиомиоцитов [12]. Изменения экстрацеллюлярного матрикса проявляются увеличением объема миокарда предсердий и накоплением в нём коллагена, что приводит к развитию фиброза. Эти процессы определяются как структурное ремоделирование миокарда при ФП [26].
Anjum Khan и соавт. в своей работе установили, что повышение коллагенообразования и обмена коллагена в предсердиях при сердечной недостаточности связано не со значительными изменениями содержания общего коллагена, а с заметными изменениями и перестройкой коллагеновых волокон в предсердном интерстиции, вместе с их осаждением [29].
Однако более подробного описания также требует изучение основных биохимических реакций, характеризующих состояние соединительнотканных структур. Не касаясь клеточных звеньев коллагенообразующей и коллагенолитической систем, Кац Я. А и соавт. [3] указывают лишь на теснейшую их взаимосвязь через важный продукт обмена – коллаген, особенностью биосинтеза которого является гидроксилирование пролина (Pro) и лизина (Lys), превращение их в оксипролин (Hpro) и оксилизин, причем Hpro является своеобразной меткой коллагена. На биосинтез коллагенового белка в организме человека идёт более 80% Pro, в чём и состоит особая значимость этой аминокислоты. Более трети аминокислотных остатков, которые стабилизируют тройную спираль коллагена по отношению к действию протеаз, приходится на Pro и Hpro [9].
Известно, что синтез Pro в человеческом организме происходит из орнитина. Таким образом, цепочка орнитин-Pro-Hpro составляет биохимическую основу в коллагенообразующей системе организма, нарушения функционирования которой могут приводить к дезорганизации соединительнотканного матрикса сосудов. Важно изучать и другие элементы соединительной ткани – эластиновые волокна. Кроме Pro, в них имеются в значительном количестве глицин (Gly), валин и аланин [10].
Однако эластин метаболически и функционально достаточно инертный субстрат, поэтому попытки к его изучению имеют относительную значимость. Предсердный фиброз при ФП является результатом сложного взаимодействия не только профибротических сигнальных путей [24]. Активация различных матриксных металлопротеиназ может также оказывать влияние на распад коллагена внеклеточного матрикса [22].

Задайте их прямо тут и получите ответ!
Или перейдите в раздел для пациентов и найдите