Свяжитесь с ним через чат или Email. Приоритет- участникам ассоциации и клиентам с аритмиями сердца
Написать сообщение
Показания к коронарной реваскуляризации при стабильной ишемической болезни сердца (ИБС), приведенные в действующих международных рекомендациях, во многом базируются на полученных более 40 лет назад данных наблюдательных исследований. Крупнейшее многоцентровое международное рандомизированное исследование ISCHEMIA призвано ответить на вопрос об оптимальной стратегии лечения при стабильной ИБС на современном этапе. Цель исследования. В настоящей статье приводится краткий обзор исследования ISCHEMIA и проанализированы важнейшие исходные характеристики включаемых в него пациентов на примере одного российского центра. Материалы и методы. Критериями включения в исследование служат наличие положительного стресс-теста (в нашем центре это стресс-эхокардиография с физической нагрузкой) с умеренным или высоким риском и подтверждение обструктивной ИБС по данным компьютерной томографическойкоронарографии (КТКГ). Основные критерии исключения: поражение ствола левой коронарной артерии по данным КТКГ, клиническое прогрессирование, дестабилизация ИБС, стенокардия IV функционального класса (ФК), фракция выброса (ФВ) <35%. Включенные пациенты рандомизированно попадают в группы консервативного или инвазивного лечения.
Цель. Оценить влияния традиционных факторов сердечно-сосудистого риска на суммарную площадь атеросклеротической бляшки (АСБ) в экстракраниальных сегментах сонных артерий.Материалы и методы. Обследованы 83 пациента (45 мужчин, 38 женщин) в возрасте 53,1±7,9 года (35- 68 лет) без верифицированной ишемической болезни сердца с одним или более традиционными факторами сердечно-сосудистого риска. Атеросклеротические изменения в сонных артериях оценивались при ультразвуковом исследовании. АСБ определялась как локальное утолщение стенки сосуда более чем на 50% в сравнении с окружающими участками или локальное утолщение стенки более чем 1,5 мм с его протрузией в просвет артерии. Площадь АСБ измерялась в продольной плоскости с наилучшей визуализацией бляшки.
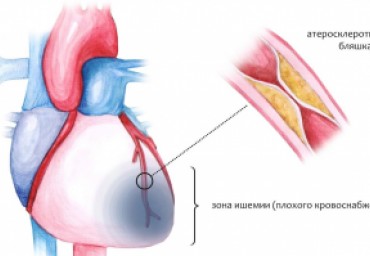
Современное лечение стабильной ИБС заключается в назначении оптимальной медикаментозной терапии, которая у ряда пациентов может быть дополнена реваскуляризацией в форме операции коронарного шунтирования или чрескожной коронарной интервенции.В рекомендациях о целесообразности проведения коронарной реваскуляризации, выпущенных при взаимодействии ведущих кардиологических и кардиохирургических сообществ, указывается, что коронарная реваскуляризация оправдана, когда ее ожидаемый положительный эффект в отношении показателей качества жизни (симптомов,функциональногосостоянияипр.), а также в отношении прогноз а превосходит ожидаемые нежелательные последствия этой процедуры. Между тем,если у пациента нет тяжелых ангинозных болей, выбрать, кому реваскуляризация показана, а кому она непринесет эффекта, бывает весь масложно.В настоящем обзоре обсуждаются принципы выбора тактики лечения пристабильной ИБС, основанные на материалах имеющихся рекомендаций кардиологических обществ и клинических исследований.
Цель. Оценить взаимосвязь между традиционными факторами сердечно-сосудистого риска и выраженностью атеросклеротических изменений в сонных артериях. Материалы и методы. Обследован 121 пациент (66 мужчин, 55 женщин) в возрасте 54,3±8 лет (35-73 лет) без верифицированной ишемической болезни сердца с одним или более традиционными факторами сердечно-сосудистого риска. Выраженность субклинического атеросклероза в сонных артериях оценивалась при ультразвуковом исследовании по толщине комплекса интима-медиа (ТКИМ). Измерение ТКИМ выполнялось в продольной плоскости по задней стенке в трех точках дистального отдела общей сонной артерии билатерально с расчетом среднего значения. Для каждого обследованного был определен 10-летний сердечно-сосудистый риск (ССР) по шкале SCORE.
Стратификация сердечно-сосудистого риска (ССР) играет важную роль в первичной профилактике атеросклероза и связанных с ним заболеваний. Общепринятые системы расчета ССР (Фремингамская шкала риска, шкала SCORE и др.), предполагающие оценку ограниченного количества традиционных факторов риска (ФР), не дают возможности с высокой точностью рассчитывать индивидуальный риск и осуществлять эффективные профилактические мероприятия. Одним из способов оптимизации оценки ССР является диагностика субклинического атеросклероза, основанная на прямой визуализации преклинических атеросклеротических изменений в стенках артерий. Ультразвуковое исследование (УЗИ) экстракраниальных сегментов сонных арте рий (СА) с оценкой толщины комплекса интима-медиа (ТКИМ) и атеросклеротических бляшек (АБ) является важным методом такой диагностики. В обзоре обсуждаются патогенетические механизмы утолщения КИМ, стандарты УЗ оценки ТКИМ и интерпретации полученных результатов, их значимость для оптимизации расчета ССР.

Ишемическая болезнь сердца является основной причиной смерти в большинстве развитых стран, причем в Российской Федерации сердечная смертность по-прежнему значительно выше, чем в Западной Европе и США. Снижение смертности от ишемической болезни сердца невозможно без использования достижений доказательной медицины в лечении пациентов, дальнейшего развития чрескожных коронарных интервенций и сердечно-сосудистой хирургии. В то же время, действительно значимый эффект способно дать только проведение профилактических мероприятий на популяционном уровне. В основе же профилактики сердечно-сосудистых заболеваний, и в частности, ишемической болезни сердца, лежит концепция коррекции факторов риска, изучению и возможностям воздействия на которые уделяется во всем мире первостепенное внимание. Известные факторы риска подразделяют на согласованные - курение, артериальная гипертензия, дислипидемия; факторы риска, связанные с образом жизни (ожирение, недостаточная физическая активность, атерогенная диета); факторы риска, значение которых уточняется; гендерные, а также генетические, расовые и этнические.
Коррекция традиционных факторов риска (ФР) на уровне популяций способствовала значительному прогрессу в профилактике ишемической болезни сердца (ИБС), достигнутому во многих странах. Вместе с тем принятые в настоящее время подходы к индивидуальному прогнозированию сердечно-сосудистых заболеваний, основанные на анализе традиционных ФР и расчете «суммарного риска» по шкалам, в ряде случаев малоэффективны. В первую очередь эта проблема касается многочисленной группы лиц с низким расчетным риском (относительно молодых пациентов, лиц без множественных ФР, женщин), за счет которой происходит наибольшее число первичных сердечно-сосудистых осложнений. Попытки улучшения индивидуального прогнозирования ИБС связаны с выявлением и введением в шкалы новых ФР и с инструментальной диагностикой субклинического атеросклероза, в первую очередь на основе ультразвукового исследования сонных артерий и мультиспиральной компьютерной томографии коронарных артерий. В обзоре обсуждается прогностическая ценность основных стандартных моделей расчета риска развития заболеваний сердца, рассматриваются возможности использования новых ФР и значение данных, получаемых при визуализации атеросклеротических изменений артерий.
У 55 пациентов, перенесших острый инфаркт миокарда, изучена возможность прогнозирования неблагоприятного характера постинфарктного рсмоделирования левого желудочка с помощью показателей тканевого доиилеровского исследования. Важнейшими предикторами неблагоприятного рсмоделирования были низкие диастолические скорости здоровых сегментов и отсутствие пика изоволюметрического сокращения в зоне дисфункции.
Обследовано 107 больных острым инфарктом миокарда (ОИМ) с подъемом сегмента ST, которым выполняли системныйтромболизисальтеплазой или стрептокиназои. Изучена возможность оценки эффективности реперфузии на основании динамики концентрации креатинкиназы (КК) и МВ-фракции креатинкиназы (MB). Критерием эффективности реперфузии служило уменьшение индекса локальной сократимости левого желудочка в динамике при эхокардиографии. Объединенный анализ профилей КК и MB с ранним пиком концентрации позволяет неинвазивно оценивать результат реперфузиив первые 24 ч после ОИМ.
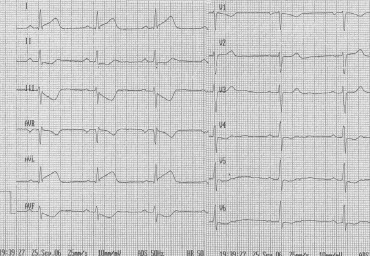
Оценка эффективности реперфузии при остром инфаркте миокарда (ОИМ) является важной клинической задачей. Проведен анализ динамики сегмента STu зубца Ту 106 пациентов с ОИМ с подъемом ST нa трех электрокардиограммах - исходной, через 3 и 48 ч после тромболизиса (ЭКГ-1, 2 и 3). Отдельно для передних и непередних инфарктов оценивались степень снижения ST в отведении с его максимальной элевацией (снижение ST max ПИМ и НПИМ) и уменьшение суммарной элевации ST во всех отведениях с его подъемом (снижение STsum ПИМ и НПИМ).

Развитие сердечной недостаточности (СН) является одним из наиболее неблагоприятных последствий острого инфаркта миокарда (ОИМ), приводящих к повышению уровня госпитализаций и смертности, причем основную долю пациентов с постинфарктной СН составляют лица пожилого возраста. У 123 пациентов был изучен ряд клинико-инструментальных показателей острого периода в качестве потенциальных предикторов развития СН в течение 12 мес после ОИМ и оценена роль возраста больных в развитии СН. Кроме того, наличие СН сопоставлено с эхокардиографическими показателями, полученными через 12 мес, и с возрастом. По окончании года наблюдения СН, преимущественно II класса NYHA, регистрировалась у 54 пациентов (44 %). Возраст пациентов был единственным независимым предиктором развития СН через 12 мес среди показателей острого периода инфаркта, отношение шансов (ОШ) составляет 1,06; 95 % доверительный интервал (ДИ) (1,01-1,12).
Представлена частота встречаемости «традиционных» факторов риска ишемической болезни сердца. Рассчитан уровень сердечно-сосудистого риска по основным системам прогнозирования. Выявлено значительное совпадение групп здоровых лиц и пациентов с дебютом ишемической болезни сердца по уровню основных факторов риска: общий холестерин, холестерин липопротеидов низкой плотности, артериальная гипертензия, сахарный диабет, семейный анамнез. Достоверные различия между группами обнаружены только по показателю курения, уровеню триглицеридов, холестерина липопротеидов высокой плотности, коэффициенту атерогенности и отношению холестерина липопротеидов низкой плотности / холестерину липопротеидов высокой плотности. У 98% пациентов регистрировался хотя бы один традиционный фактор риска.
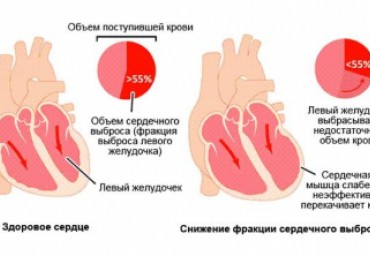
Фракция выброса является важнейшим прогностическим параметром у кардиологических вольных. После острого инфаркта миокарда могут наблюдаться разнонаправленные изменения фракции выброса, связанные с ремоделированием левого желудочка. Прогнозирование характера этих изменений является важной клинической задачей. Проведено 12-месячное наблюдение 115 больных, перенесших острый инфаркт миокарда с подъемом сегмента ST. В качестве предикторов величины эхокардиографической фракции выброса через 12 мес. изучен ряд клинических, лабораторных, электрокардиографических и эхокардиографических показателей острого периода инфаркта, доступных в повседневной клинической практике. Через 12 мес. неблагоприятная для прогноза величина фракции выброса <40% наблюдалась у 23 пациентов (группа R1). Пациенты с фракцией выброса >4()%- при эхокардиографии через 12 мес. составили группу Rn (n=92). Из 18 пациентов, имевших при исходной эхокардиографии фракцию выброса <4()%, ее значение в этом диапазоне через 12 мес.регистрировалась только у 4, р<0,()5.
В настоящем исследовании изучалась возможность прогнозирования неблагоприятного изменения конечно-систолического индекса левого желудочка через 12 мес после острого инфаркта миокарда на основании ряда исходных эхокардиографических параметров, включая стандартные и полученные при тканевом допплеровском исследовании. Обследовано 192 пациента, перенесших острый инфаркт миокарда с подъемом сегмента ST, которым был выполнен системный тромболизис.
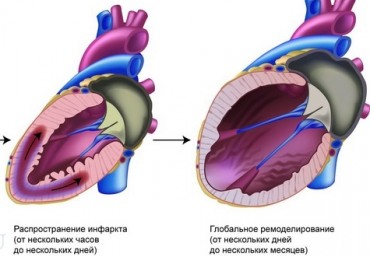
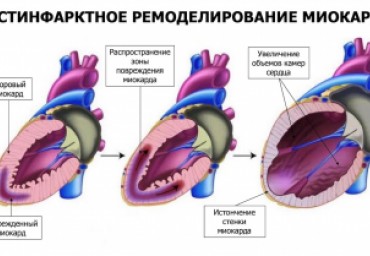
Прогнозирование неблагоприятного ремоделирования левого желудочка после острого инфаркта миокарда - актуальная клиническая задача. В работе получены данные о частоте изменений основных параметров объема и функции левого желудочка, связанных с постинфарктнымремоделированием. Показана возможность прогнозирования неблагоприятного ремоделирования с использованием ряда ферментных, электрокардиографических, в первую очередь эхокардиографических (в том числе тканевых допплеровских), показателей. Созданный на основе полученных данных прогностический алгоритм может способствовать оптимизации тактики ведения больных, перенесших инфаркт миокарда.
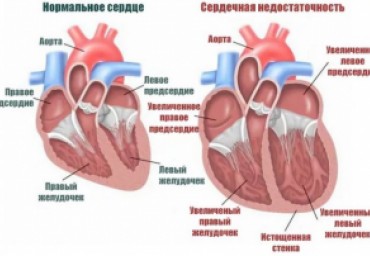
Актуальность. Несмотря на уменьшение частоты развития сердечной недостаточности (СН) в остром периоде инфаркта миокарда (ОИМ), отмечается сохранение ее роли, как причины госпитализаций и смертности в отдаленные сроки. Закономерности отсроченного развития СН после ОИМ изучены относительно мало. Цель. Изучение прогностической ценности ряда исходных клинических, лабораторных и инструментальных показателей в отношении развития СН в течение 12 мес. после ОИМ. Материалы и методы. Обследовано 123 пациента без предшествующей СН, перенесших ОИМ с подъемом сегмента ST и системный тромболизис, а затем получавших медикаментозную терапию. Клинические параметры оценивались при поступлении и в конце исследования. ЭКГ регистрировались до и через 3 ч после тромболизиса (ЭКГ-1 и ЭКГ-2).
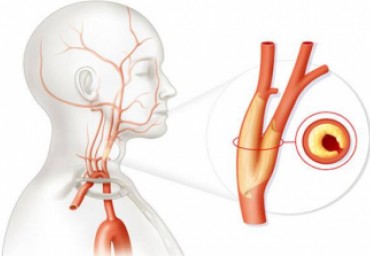
Цель исследования - выявить взаимосвязь между параметрами «отрицательного» ишемического стресс-теста и субклиническим атеросклерозом сонных артерий (СА). В одномоментное исследование были включены 204 пациента (100 женщин и 104 мужчины) в возрасте 54,16±8,07 года без верифицированной ишемической болезни сердца, имеющих ≥1 традиционного фактора риска развития сердечно-сосудистых осложнений. Пациентам выполнялись электрокардиографический стресс-тест на тредмиле и ультразвуковое исследование СА. Критериями субклинического атеросклероза являлись толщина интимы-медии (TИМ) в трех экстракраниальных сегментах СА, наличие и суммарная площадь атеросклеротической бляшки (СПАСБ).
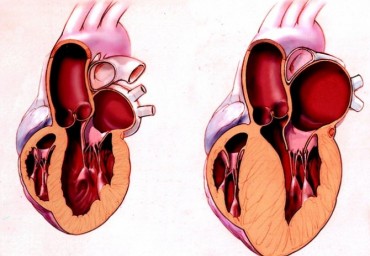
Неблагоприятный характер постинфарктного ремоделирования левого желудочка сопровождается высоким риском сердечных осложнений. Возможности его прогнозирования изучены у 187 пациентов, перенесших острый инфаркт миокарда с подъемом сегмента ST. Выявлены важнейшие предикторы характера ремоделирования: результат реперфузии (при непередних инфарктах), максимальнаяэлевация сегмента ST, максимальные концентрации сердечных ферментов в течение первых суток инфаркта, индекс локальной сократимости, а также исходный конечно-систолический индекс левого желудочка. На основании найденных предикторов сформулирован алгоритм прогнозирования неблагоприятного ремоделирования в целом. Библиогр. 35 назв. Ил. 2. Табл. 4.
Представлены результаты обследования 81 пациента (64 мужчин и 17 женщин), последовательно поступивших в Покровскую больницу Санкт-Петербурга с дебютом ишемической болезни сердца. Изучена частота встречаемости «традиционных» факторов риска ИБС. Рассчитан уровень сердечно-сосудистого риска по основным системам прогнозирования. Анализ полученных данных показал, что наиболее распространенными традиционными факторами риска являлись дислипидемия (89%), ее различные варианты встречались с одинаковой частотой; также часто наблюдались артериальная гипертензия (74%) и курение (66%). Выявлено, что у всех пациентов имелся хотя бы один традиционный фактор риска, причем чаще всего встречалось сочетание двух и трех факторов риска, а по данным коронарографии преобладало одно-сосудистое поражение. Суммарный сердечно-сосудистый риск большинства пациентов соответствовал среднему уровню. Применение шкалы SCORE у обследованных пациентов до дебюта ИБС в большем числе случаев чем использование Фремингемской шкалы риска, позволило бы точно оценить фактический высокий риск заболевания, однако для обеих шкал доля корректной оценки риска была невысокой (22%; 95% ДИ 13,7-32,8 по SCORE и 12,3; 95% ДИ 6,1-21,5 по Фремингемской шкале риска р< 0,05). Назначению статинов до дебюта ИБС подлежали бы: по Фремингемской шкале риска 55,4% (95% ДИ 42,5-67,7) пациентов; согласно Европейским рекомендациям - достоверно больше: 89,2% (95% ДИ 79,1-95,6), p < 0,05.
Неблагоприятный характер ремоделирования левого желудочка после острого инфаркта миокарда сопровождается высоким риском развития повторных сердечных осложнений: повторного инфаркта, сердечной недостаточности, внезапной сердечной смерти. В обзоре обсуждаются варианты течения ремоделирования после острого инфаркта миокарда и возможности его прогнозирования на основании изучения клинических, ферментных, электрокардиографических и эхокардиографических, в том числе тканевых допплеровских, параметров, доступных для анализа в остром периоде инфаркта миокарда. Поскольку одним из важных факторов, предопределяющих течение ремоделирования, является успешность проводимой в первые часы инфаркта коронарной реперфузии, в обзоре также рассмотрены методики неинвазивной оценки результатов реперфузии
Тромбоэмболия легочной артерии (ТЭЛА) представляет собой одно из самых распространенных кардиологических заболеваний, сопоставимых по частоте с острым коронарным синдромом, и является одной из ведущих причин сердечно-сосудистой смертности. Высокая летальность, связанная с ТЭЛА, определяется тяжестью заболевания и сложностями диагностики, а его распространенность в большой степени обусловлена недостаточной информированностью врачей о стандартах первичной профилактики.Последнее десятилетие отмечено качественным повышением эффективности диагностики ТЭЛА, которое связано с совершенствованием эхокардиографии и увеличением доступности компьютерной томографической ангиографии легочного русла в реальной практике. Существенно дополнен перечень антикоагулянтных препаратов, являющихся основой патогенетического лечения, вторичной и первичной профилактики ТЭЛА.Настоящий обзор посвящен принципам диагностики, терапии и профилактики этого актуального заболевания.
Стресс-эхокардиография является одной из ведущих неинвазивных методик диагностики ишемической болезни сердца, недостатком которой считается определенная субъективность анализа данных. Для преодоления ее в последние годы предложен ряд новых методик анализа локальной функции левого желудочка, связанных с использованием тканевого допплеровского режима, а также более современной технологии тканевого следа. Они дают возможность количественного измерения таких параметров, как скорость движения, деформация и скорость деформации миокарда левого желудочка, что делает диагностику ишемии менее зависимой от качества субъективной визуальной оценки. Настоящий обзор посвящен описанию методов и методик, характеризующих локальную функцию левого желудочка, подходов к их использованию и их роли в анализе данных стресс-эхокардиографии.
Нестабильная стенокардия (НС) и ИМ без элевации сегмента ST (ИМБП ST) являются наиболее распространенными формами ОКС. Закономерно, что оптимизация диагностики и лечения этой актуальной патологии является одним из важнейших направленийпроводящихся в последние годы научных исследований. Среди них одно из центральных мест занимают работы, посвященные разработке и использованию антитромботических препаратов - основы патогенетической терапии ОКС. В этой области наблюдается быстрый прогресс, приведший к появлению целого арсенала новых антитромбоцитарных и антикоагулянтных препаратов. В обзоре освещаются текущие стандарты применения антитромботических препаратов при НС и ИМБП ST, а также перспективы антитромботической терапии, о которых можно судить по результатам исследований, опубликованным уже после и, о которых можно судить по результатам исследований, опубликованным уже послевыхода последних официальных рекомендаций кардиологических обществ.
Актуальность.Хорошоизвестно,чтоатеросклерозначинаетразвиватьсязадолгодопоявлениясимптомов(субклинический,илипреклиническийатеросклероз).Всвязисэтимвсебольшеезначениепридаетсяпрофилактикеатеросклеротическихзаболеваний–выявлениюнадоклиническомэтапелицсвысокимрискомсердечно-сосудистыхосложнений.Цель.Оценитьраспространенностьатеросклерозасонныхартерийубессимптомныхлициизучитьвзаимосвязьмеждувыраженностьюсубклиническогоатеросклерозаитрадиционнымифакторамисердечно-сосудистогориска.
Высокие заболеваемость и смертность от ишемической болезни сердца (ИБС) в РФ обусловливают значимость индивидуального прогнозирования риска сердечно-сосудистых заболеваний и проведения первичной профилактики. Цель. Проанализировать уровень риска, который мог бы быть рассчитан у пациентов с дебютом ИБС непосредственно перед манифестацией заболевания и таким образом оценить возможности прогнозирования дебюта ИБС с помощью стандартных шкал; оценить соответствие фактического объема мероприятий первичной профилактики действующим Рекомендациям. Материал и методы. У 122 пациентов, госпитализированных с дебютом ИБС в виде острого коронарного синдрома, выполнена ретроспективная оценка сердечно-сосудистого риска, который мог бы быть выявлен у них непосредственно до развития заболевания. Результаты. Частота традиционных факторов риска среди лиц с дебютом ИБС была высокой: 88% пациентов имели ≥3 факторов риска.
Введение: В настоящее время электрокардиографический тест с физической нагрузкой широко используется для подтверждения диагноза ишемической болезни сердца (ИБС) при клиническом подозрении на это заболевание и не рекомендован в целях скрининга.
Результаты отрицательного ишемического стресс-теста, как правило, не принимаются во внимание. Между тем, имеются данные о корреляции неэлектрокардиографических параметров теста с риском развития сердечно-сосудистых осложнений.
Ишемическая болезнь сердца (ИБС) является ведущей причиной смерти во всем мире, а стабильная ИБС — одной из важнейших ее клинических форм. За последнее десятилетие накоплены новые данные, касающиеся алгоритмов диагностики, медикаментозного лечения и реваскуляризации миокарда при стабильной ИБС. Результатом стала публикация в 2012 г. Американских, а в 2013 г. — европейских рекомендаций по диагностике и терапии стабильной ИБС. В настоящей статье рассмотрены основные алгоритмы диагностики и лечения пациентов со стабильной ИБС, исходя из имеющейся на данный момент доказательной базы, с учетом результатов последних исследований и международных клинических рекомендаций.
Цель исследования. Выявление взаимосвязи между показателями ремоделирования сердца и стандартными эхокардиографическими параметрами функции левого желудочка.Материалы и методы. 11 пациентам, средний возраст 61,3±6,8 лет (8 мужчин, 3 женщины), перенесшим инфаркт миокарда в срок от 8 лет до 6 месяцев с фракцией выброса менее 55 % при эхокардиографии, имеющим гемодинамически значимые стенозы ≥ 1 коронарной артерии по данным коронарографии, выполнена эхокардиография. Для оценки функции левого желудочка измеряли фракцию выброса (ФВ) и митрально-септальную сепарацию (EPSS). Измеряли следующие показатели ремоделирования: конечнодиастолический размер и объем левого желудочка (КДР и КДО), систолический и диастолический индекс сферичности (ИСс и ИСд), систолический и диастолический миокардиальный стресс по меридиану (МСМс и МСМд), Teiиндекс левого желудочка, маркер жизнеспособного миокарда TVЕ-VEa (интервал между началом раннего трансмитрального кровотока VE и началом раннего диастолического движения бокового сегмента митрального кольца VEa в тканевом допплеровском режиме).
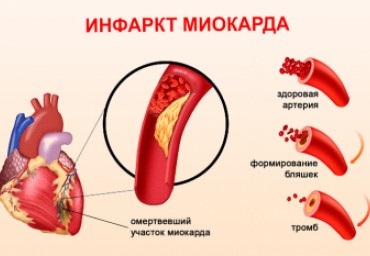
Современные принципы лечения острого инфаркта, связанные с попыткой ограничения его объема, были впервые сформулированы в 1974 г. [2]. В середи не 1990Dх гг. было статистически подтверждено, что успешная реперфузия, выполненная при остром инфаркте миокарда с подъемом ST, сопровождается ограничением его размеров, уменьшением степени сократительной дисфункции левого желудочка, и, в результате, улучшением выживаемости.
Важнейшими задачами эхокардиографического исследования при ишемической болезни сердца (ИБС) являются оценка регионарной и глобальной систолической и диастолической функции левого желудочка (ЛЖ). Разработанная в последние годы методика тканевого допплеровского исследования (ТДИ), значение и сферы применения которой сейчас интенсивно изучаются, дала возможность получить большое количество принципиально новой информации о механике работы ЛЖ – прежде всего, позволила количественно оценивать его локальную сократимость. Это стало значительным шагом вперед в изучении патологии сердца при ряде важнейших заболеваний, в том числе, ИБС. Данный обзор посвящен описанию принципов метода ТДИ и областей его применения при ИБС
Значимость клинической проблемы тромбоэмболии легочной артерии (ТЭЛА) обусловлена высокой распространенностью заболевания, высокой смертностью и диагностическими трудностями. Представленный в статье клинический случай посвящен диагностике и лечению ТЭЛА у пациента со стабильной гемодинамикой в свете обновлений, появившихся в европейских клинических рекомендациях 2014 г.
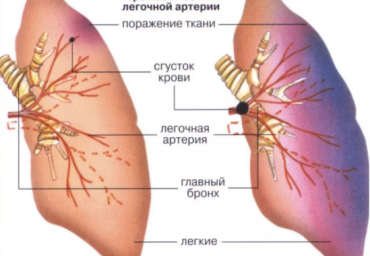
Тромбоэмболия легочной артерии (ТЭЛА) представляет собой одно из самых распространенных кардиологических заболеваний, сопоставимых по распространенности с острым коронарным синдромом, и занимает 3-е место в структуре сердечно-сосудистой смертности. ТЭЛА нередко служит непосредственной причиной смерти при целом ряде тяжелых кардиологических и некардиологических заболеваний (сердечная недостаточность, злокачественные опухоли), а может и возникать без видимых предвестников у практически здоровых молодых людей, например, в результате иммобилизации при лечении травмы. Согласно данным, приводимым в новых Европейских рекомендациях [1], в 34% случаев ТЭЛА впервые проявляется как внезапная сердечная смерть. Лишь в 7% случаев диагноз ставится прижизненно, в то же время в 59% случаев ― неправильно. Действительно, клиническая диагностика ТЭЛА осложнена неспецифичностью клинической картины и малой информативностью обычных диагностических методик.
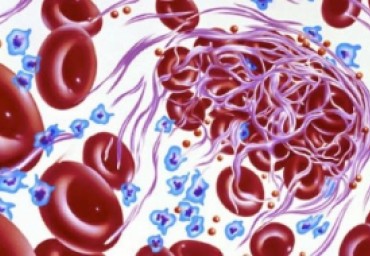
Венозная тромбоэмболия (тромбоз глубоких вен — ТГВ и тромбоэмболия легочной артерии — ТЭЛА) представляет собой одно из самых распространенных кардиологических заболеваний; ТЭЛА занимает 3-е место в структуре сердечно-сосудистой смертности. Частота развития ТЭЛА в Европе составляет 100—200 случаев на 100 тыс. населения (для сравнения – острый коронарный синдром без подъема сегмента ST — 300 случаев на 100 тыс. населения). В 34% случаев ТЭЛА манифестирует как внезапная сердечная смерть, причем у 59% этих пациентов правильный диагноз не устанавливается при жизни [1, 2]. ТЭЛА нередко служит непосредственной причиной смерти при целом ряде тяжелых кардиологических и некардиологических состояний (сердечная недостаточность, злокачественные опухоли), а может возникать без видимых предвестников у практически здоровых молодых людей, например, в результате длительной иммобилизации (многочасовые перелеты) или у пациенток, принимающих пероральные контрацептивы.